Hva består proteinet av? Eksempler på enkle og komplekse proteiner
For å forestille seg betydningen av proteiner,det er nok å huske den velkjente frasen av Friedrich Engels: "Livet er en måte å eksistere av proteinlegemer". Faktisk på jorda forårsaker disse stoffene sammen med nukleinsyrer alle manifestasjoner av levende materie. I dette papiret finner vi ut hva proteinet består av, hvilken funksjon den skal utføre, og bestemmer også egenskapene til strukturen til forskjellige arter.
Peptider - høyt organiserte polymerer
Faktisk, i en levende celle som en plante,både dyr og dyr, proteiner kvantifiserer over andre organiske stoffer, og utfører også det største antall forskjellige funksjoner. De deltar i en rekke svært viktige cellulære prosesser, for eksempel bevegelse, forsvar, signalering og så videre. For eksempel i peptidvev hos dyr og mennesker utgjør peptider opptil 85% av tørrstoffmassen, og i bein og dermis, fra 15-50%.

Alle cellulære og vevsproteiner består avaminosyrer (20 arter). Antallet deres i levende organismer er alltid lik 20 typer. Ulike kombinasjoner av peptidmonomerer danner en rekke proteiner i naturen. Den beregnes av det astronomiske tallet 2x1018 mulige arter. I biokjemien kalles polypeptider høymolekylære biologiske polymerer, makromolekyler.
Aminosyrer - monomerer av proteiner
Alle 20 typer av disse kjemiske forbindelsene er strukturelle enheter av proteiner og har den generelle formel NH2R-COOH. De er amfoteriske organiske stoffer som er i stand til å vise både grunnleggende og sure egenskaper. Ikke bare enkle proteiner, men også komplekse, inneholder såkalte ikke-essensielle aminosyrer. Men de vesentlige monomerer, så som valin, lysin, metionin kan finnes bare i visse typer av proteiner som kalles belkov.Takie nytten.

Derfor tar karakterisering av polymeren ikke bare hensyn tilhvor mange aminosyrer et protein er laget av, men hvilke monomerer er bundet av peptidbindinger til makromolekylen. Vi legger også til at utskiftbare aminosyrer, som asparagin, glutaminsyre, cystein, kan syntetiseres uavhengig i mennesker og dyrceller. Irreplaceable monomerer av proteiner dannes i celler av bakterier, planter og sopp. De angir bare heterotrofe organismer med mat.
Hvordan polypeptidet dannes
Som kjent kan 20 forskjellige aminosyrerå forene i en mengde av alle mulige proteinmolekyler. Hvordan forekommer bindingen av monomerer blant seg selv? Det viser seg at karboksyl- og aminegruppene i en rekke liggende aminosyrer interagerer med hverandre. Såkalte peptidbindinger dannes, og vannmolekyler frigjøres som et biprodukt av polykondensasjonsreaksjonen. Proteinmolekylene som dannes består av aminosyrerester og gjentatte repeterende peptidbindinger. Derfor kalles de også polypeptider.
Ofte kan proteiner inneholde ikke en, men samtidigflere polypeptidkjeder og består av mange tusen aminosyrerester. Videre kan enkle proteiner, så vel som proteider, komplisere deres romlige konfigurasjon. Dette skaper ikke bare en primær, men også en sekundær, tertiær og enda kvaternær struktur. La oss se nærmere på denne prosessen. Fortsetter å studere spørsmålet: Hva består proteinet av, hva er konfigurasjonen av denne makromolekylen. Vi har fastslått over at polypeptidkjeden inneholder et antall kovalente kjemiske bindinger. Det er denne strukturen som kalles primær.

En viktig rolle er spilt av kvantitative ogden kvalitative sammensetningen av aminosyrer, så vel som sekvensen av deres forbindelse. Sekundær struktur oppstår på tidspunktet for spiraldannelsen. Den stabiliseres av mange nye hydrogenbindinger.
Høyere nivåer av proteinorganisasjon
Tertiær struktur fremkommer som et resultat avhelix pakking av en sfære - kuler, f.eks muskelprotein myoglobin stoff har nettopp en slik romlig struktur. Den opprettholdes av både nyopprettede hydrogenbindinger og disulfidbroer (hvis flere cysteinrester kommer inn i proteinmolekylet). Kvaternære form - denne er resultatet av å kombinere i en enkelt struktur flere proteinkuler av nye typer interaksjoner, for eksempel hydrofobt eller elektrostatisk. Sammen med peptidene kommer ikke-proteindeler også inn i kvaternærstrukturen. De kan være ioner av magnesium, jern, kobber eller rester av ortofosfat eller nukleinsyrer, så vel som lipider.
Egenskaper av proteinbiosyntese
Tidligere fant vi ut hva proteinet består av. Den er bygget fra en sekvens av aminosyrer. Deres montering i en polypeptidkjede forekommer i ribosomer - ikke-membranorganeller av plante- og dyreceller. Molekyler av informasjon og transport RNA deltar også i prosessen med biosyntese. Den førstnevnte er matrisen for proteinmontering, og sistnevnte transporterer forskjellige aminosyrer. Det er et dilemma i prosessen med cellulær biosyntese, det vil si proteinet består av nukleotider eller aminosyrer? Svaret er entydig - polypeptider, både enkle og komplekse, består av amfotere organiske forbindelser - aminosyrer. I cellens livssyklus er det perioder med aktivitet, når syntese av proteiner er spesielt aktiv. Dette er de såkalte stadiene J1 og J2 i interfasen. På denne tiden vokser cellen aktivt og trenger mye byggemateriale, som er proteinet. Videre, som et resultat av mitotiske avslutning danner to datterceller, som hver trenger en stor mengde av organiske stoffer, men i kanalene glatte endoplasmatiske retikulum er aktiv syntese av lipider og karbohydrater, og i den granulære EPM oppstår biosyntesen av proteiner.
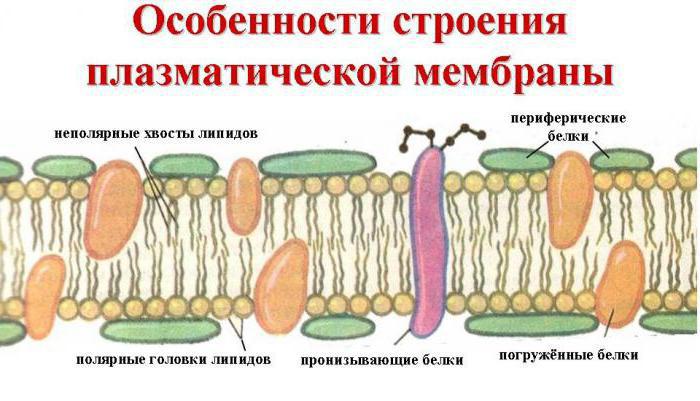
Funksjoner av proteiner
Å vite hva proteinet består av, kan du forklare hvordanet stort utvalg av deres arter, og de unike egenskapene som er forbundet med disse stoffene. Proteiner utfører en rekke funksjoner i cellen, for eksempel konstruksjon, da de er en del av membranene til alle celler og organeller: mitokondrier, kloroplaster, lysosomer, Golgi-komplekset og så videre. Slike peptider som gamoglobuliner eller antistoffer er eksempler på enkle proteiner som utfører en beskyttende funksjon. Med andre ord er cellulær immunitet et resultat av virkningen av disse stoffene. Kompleks protein - hemocyanin, sammen med hemoglobin, utfører i dyr en transportfunksjon, det vil si oksygen i blodet. Signalproteiner som lager opp cellemembraner, gir informasjon til cellen selv om stoffer som forsøker å komme inn i cytoplasma. Peptidalbumin er ansvarlig for de grunnleggende blodtallene, for eksempel for dets evne til å koagulere. Protein av kyllingegg ovalbumin lagres i et bur og fungerer som hovedkilden til næringsstoffer.

Proteiner er grunnlaget for cellens cytoskelet
En av de viktigste funksjonene til peptider er støtten. Det er svært viktig for å opprettholde form og volum av levende celler. Den såkalte struktur submembrane - mikrotubuli og mikrofilamenter sammenvevd for å danne et indre skjelett av cellene. Proteiner som er inkludert i sammensetningen, f.eks tubulin, lett kan komprimeres og strekkes. Dette hjelper cellen til å beholde sin form under ulike mekaniske deformasjoner.
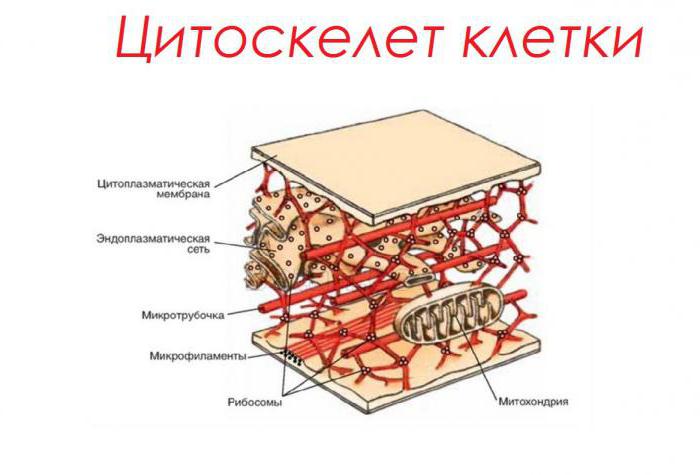
I planteceller, sammen med proteinerhyaloplasma, understøttes funksjonen også av cytoplasmatiske tråder-plasmodesmata. Passerer gjennom porene i cellevegget, forårsaker de forholdet mellom en rekke liggende cellulære strukturer som danner plantevev.
Enzymer er stoffer av protein natur
En av de viktigste egenskapene til proteiner er deres innflytelsepå frekvensen av kjemiske reaksjoner. Hovedproteinene er i stand til delvis denaturering - prosessen med å slappe av makromolekylet i tertiær eller kvaternær struktur. Polypeptidkjeden selv bryter ikke ned. Delvis denaturering ligger under både signalets og katalytiske funksjoner av proteinet. Den siste egenskapen er enzymens evne til å påvirke mengden av biokjemiske reaksjoner i kjernen og cytoplasmaet til cellen. Peptider, som tvert imot reduserer hastigheten på kjemiske prosesser, kalles vanligvis ikke inhibitorer, men enzymer. For eksempel er et enkelt katalaseprotein et enzym som akselererer spaltningen av det giftige stoffet av hydrogenperoksid. Det er dannet som det endelige produktet av mange kjemiske reaksjoner. Catalase akselererer utnyttelsen til nøytrale stoffer: vann og oksygen.

Egenskaper av proteiner
Peptider er klassifisert av mange funksjoner. For eksempel, i forhold til vann, kan de deles inn i hydrofile og hydrofobiske. Temperatur påvirker også strukturen og egenskapene til proteinmolekyler på forskjellige måter. For eksempel kan proteinkeratin - en komponent av negler og hår tåle både lave og høye temperaturer, det vil si det er termolabilt. Men proteinet ovalbumin, som allerede er nevnt tidligere, når det er oppvarmet til 80-100 ° C, helt ødelagt. Dette betyr at dets primære struktur er delt inn i aminosyrerester. Denne prosessen kalles ødeleggelse. Uansett betingelser vi lager, kan proteinet ikke returnere til den opprinnelige formen. Motorproteiner - aktin og milosin er tilstede i muskelfibre. Deres alternative sammentrekning og avslapning er grunnlaget for arbeidet i muskelvevet.







