Hva er allotropi? Allotropi av karbon, kjemi
Årsaker til en rekke organiske forbindelser -Karbonatomens evne til å danne forskjellige kjeder og sykluser, forbinder med hverandre. Det er fenomenet isomerisme. Og hva er årsaken til mangfoldet av enkle uorganiske stoffer? Det viser seg at dette spørsmålet kan besvares ved å vurdere hva allotropi er. Det er med dette naturlige fenomenet i kjemiske elementer at eksistensen av ulike former for enkle forbindelser er forbundet.
Hva er allotropi?
Du kan svare på dette spørsmålet på denne måten. Dette fenomenet er eksistensen av det samme kjemiske elementet i form av flere enkle stoffer. Det vil si at hvis cellene i periodisk tabell 118, betyr dette ikke at det er så mange atomer i atomens natur også. Hver av elementene (nesten alle) har en eller flere varianter, eller allotrope modifikasjoner.
Hva er forskjellen mellom slike stoffer? Årsakene til dette fenomenet er de to viktigste:
- forskjellig antall atomer i molekylet (allotropi av sammensetningen);
- ulik struktur av krystallgitteret (form allotropi).
Ofte er dette konseptet knyttet til begrepetpolymorfisme. Det er imidlertid en forskjell mellom dem. Hva er allotropi? Dette er en modifisering av det kjemiske elementet i forskjellige enkle stoffer, uavhengig av tilstanden til aggregattilstanden. Mens polymorfisme er et konsept som bare gjelder for faste krystallinske stoffer.
Ulike allotrope modifikasjoner av forbindelserDet er vanlig å bruke latinske bokstaver før navnet sitt. Alfa er alltid plassert før skjemaet som har det minste smeltepunktet, kokepunktet. Videre i alfabetisk rekkefølge og økning i indikatorer tilsvarende.
Til tross for det faktum at det kjemiske elementet på basenenkle stoffer er de samme, egenskapene til modifikasjonene avviger vesentlig fra hverandre, både fysisk og kjemisk. Den lettest dannede allotropiske former:
- ikke-metaller (unntatt halogener og inerte gasser);
- semimetals.
Allotropien av metaller har vært minst studert sidende gjør modifikasjoner motvillig og ikke alle. Totalt er det kjent at over 400 forskjellige former for enkle stoffer er kjent. Jo flere grader av oksidasjon er karakteristisk for et element, jo høyere antall allotropiske modifikasjoner som er kjent for det.

Modifikasjoner av karbon
Carbon allotropi er den vanligsteog et levende eksempel som illustrerer fenomenet under vurdering. Tross alt er dette elementet i stand til å danne flere typer forbindelser, forskjellig i krystallgitterets struktur. De resulterende enkle stoffene er så polare i sine egenskaper at det forblir å bli overrasket over naturens løsninger.
Så, allotropi av karbon inneholder følgende modifikasjoner.
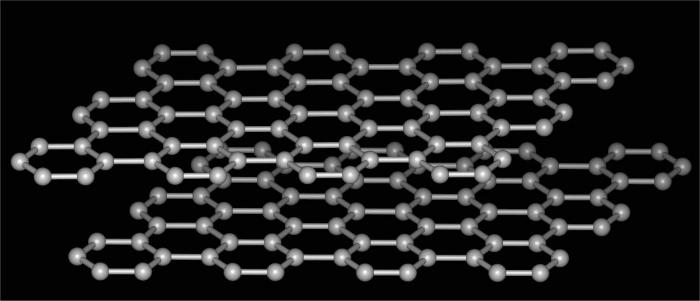
- Hva er allotropien av karbon kan spores ogpå sin neste form, som er radikalt forskjellig fra den forrige. Dette er grafitt. Veldig myk stoff som lett kan skrelle og la et karakteristisk spor på papir. Derfor brukes den til fremstilling av glidelås av enkle blyanter. Strukturen i denne formen er sekskantet lagdelt. Obligasjonene mellom mellomlagene er svake, lett revet, tetningens tetthet er lavt. Brukt grafitt for produksjon av syntetiske diamanter, som et fast smøremiddel, for fremstilling av elektroder, som fyllstoff av plast, så vel som i kjernereaktorer.
- Fullerenes er enda et bevis på atdet er allotropi. Kjemien til disse forbindelsene ligner den av aromatiske hydrokarboner. Tross alt er deres struktur representert av konvekse lukkede polyeder som ligner en fotball. Fullerenes brukes i engineering som en halvleder, for produksjon av superledende forbindelser, som fotoresist og så videre.
- Lonsdaleitt og keraffitt - to mer krystallinskallotrope modifikasjoner av karbon. De ble oppdaget relativt nylig. Av egenskaper er svært lik diamant, i fravær av urenheter kan være enda flere ganger vanskeligere.
- Kull og sot er amorfe allotrope stoffer. Brukes som drivstoff, smøremidler, i filtre og så videre. Av innhold i naturen, den vanligste av alle modifikasjoner av karbon.

diamant
Det vanskeligste av alt kjent for i dagstoffer, beregnet til 10 poeng på Mohs skalaen. Den krystallinske formen av karbon, hvis struktur har formen av riktig sammenhengende tetraedrale formasjoner til hverandre.
En diamant er i stand til å spre lys veldig bra, detlar deg bruke det som et smykke (diamanter). På grunn av ekstrem hardhet brukes den til kutting og sveising, boring, polering og sliping. Til dags dato er produksjon av kunstige diamanter brukt i industrien etablert.
Andre varianter
Det finnes også flere varianter av dette elementet:
- nanorør;
- nanofoam;
- Astrolite;
- nanofibers;
- glassaktig karbon;
- grafitt;
- carbine;
- nanobuds.
Ubekreftet, men antatt former for eksistens av enkle karbonforbindelser: kaot, metallkarbon og karbondioksid.

Allotropi av oksygen
Dette ikke-metallet danner to enkle stoffer:
- gass oksygen (under normale forhold), hvis formel er O2;
- gassformig ozon, den empiriske refleksjon av hvilken sammensetning O3.
Åpenbart er her hovedårsakeneksistensen av modifikasjoner - sammensetningen av molekylet. Vanlig oksygen er grunnlaget for livet til alle levende vesener (med unntak av anaerobe bakterier). Han er en aktiv deltaker i gassutveksling, en kilde til energi for alle livsprosesser. Kjemisk er det en oksidasjonsmiddel, gjennom hvilken mange reaksjoner utføres.
Ozon er dannet i natur eller spesielllaboratorieinstallasjoner av ozonisatorer fra oksygen av luft under påvirkning av kraftig utslipp av elektrisitet. Under naturlige forhold er dette lynet. I lavt spredte konsentrasjoner har det en hyggelig lukt av friskhet (etter tordenvær er det alltid følt i luften). Det er en veldig sterk oksidasjonsmiddel, blekemiddel, kjemisk aktiv.

Modifikasjoner av fosfor
Allotropi av oksygen ligner på fosfor. Det har også om lag 11 forskjellige modifikasjoner, forskjellig i antall atomer i molekylet, og derfor den kjemiske bindingen og egenskapene. Det er tre stabile former og resten, i naturen, praktisk talt ikke forekommende og forfall.
- Hvit fosfor. Formelen av dens P4. Et stoff som ligner en myk paraffin av hvit eller litt gulaktig farge. Smelter lett, passerer inn i en giftig gass.
- Rødt fosfor er en pastalignende masse med en ubehagelig lukt. Formel - Pn. Dette er en polymerstruktur.
- Svart fosfor er en fett i berøringsmassen, som er svart og helt uoppløselig i vann.
Modifikasjoner av metaller
Hva er allotropien av metaller, du kan lære av jernstoffet. Den finnes i skjemaet:
- a;
- beta;
- gamma;
- sigma form.
Hver avviker fra den tidligere strukturen av krystallgitteret og følgelig egenskaper. For eksempel er alfa-skjemaet ferromagnetisk, og beta-paramagnetet.
Generelt utgjør allotrope modifikasjoner fra alle kjente metaller bare 27 kjemiske elementer.

Allotrope av tinn
Interessant er alfaformen gråEt pulver som bare finnes ved lave temperaturer. Beta-form, tvert imot, er metall, sølvfarget, mykt og plast. Den finnes ved høye temperaturer - opp til 161 omtrentC. En form passerer lett inn i den andre under naturlige forhold, hvis det er en gradientforskjell.





