Produksjon av hydrogensulfid, dets egenskaper, anvendelse
I denne artikkelen vil vi vurdere produksjonen av hydrogensulfid fra svovel. La oss ta en nærmere titt på stoffets fysiske og kjemiske egenskaper.

struktur
For å analysere hovedrollenmottak av hydrogensulfid, er det nødvendig å finne ut de særegne strukturen. Dette stoffet inneholder ett svovelatom og to hydrogen. De er ikke-metalliske, slik at kovalente polære bindinger dannes mellom elementene. I hydrogensulfid er det en vinkelstruktur. Mellom svovel og hydrogen dannes en vinkel på 92 grader, noe som er litt mindre enn i vann.

Fysiske egenskaper
Lukten av hydrogensulfid, som minner om råtne egg,kjent for alle. Under normale forhold er dette stoffet i gassform. Det har ingen farge, er dårlig oppløselig i vann, giftig. I gjennomsnitt, ved 20 grader Celsius, vil 2,4 volum hydrogensulfid oppløses i vann. Ved svovelholdig vann avsløres svake sure egenskaper, dissociasjonen av stoffet fortsetter trinnvis. Giftig hydrogensulfid er farlig selv i små doser. Det luftbårne innholdet på ca. 0,1 prosent av hydrogensulfid fører til lammelse av luftveiene med bevissthetstap. For eksempel døde den legendariske naturalisten Pliny den eldste i det 79. århundre f.Kr. nettopp fra hydrogensulfid, som ble dannet under utbruddet av Vesuvius.
Årsaken til forgiftningseffekten av hydrogensulfid i dets kjemiske interaksjon med blodets hemoglobin. Jernet som finnes i dette proteinet danner et sulfid med hydrogensulfid.
Maksimalt tillatt konsentrasjon i lufthydrogensulfid regnes som 0,01 mg / l. Som en motgift brukes inhalasjon av rent oksygen eller luft, der det er en ubetydelig mengde klor.
Arbeid med hydrogensulfid innebærer overholdelse av visse sikkerhetsregler. Alle eksperimenter som involverer dette gassformige stoffet utføres i forseglede enheter og avtrekksdeksler.

Metoder for produksjon av hydrogensulfid
Hva er produksjon av hydrogensulfid i laboratoriet? Det vanligste alternativet er samspillet mellom hydrogen og svovel. Denne kjemiske reaksjonen refererer til en forbindelse som utføres i en avtrekksdeksel.
I tillegg er produksjonen av hydrogensulfid også mulig medbytte mellom fast jernsulfid (2) og en oppløsning av svovelsyre eller saltsyre. For å få dette resultatet, er det nok å ta noen stykker sulfid i et reagensrør, som ikke overstiger størrelsen på en ert. Videre tilsettes en løsning av syren til røret (opp til halvparten av volumet), dekket med et gassutløpsrør. Enheten er plassert under hetten, røret er oppvarmet. Det kjemiske samspillet ledsages av frigjøring av gassbobler. Slike produksjon av hydrogensulfid gjør det mulig å skape en mengde av et stoff som er tilstrekkelig til å vurdere dets kjemiske egenskaper.
Hvilke andre måter er der? Laboratoriet tillater fremstilling av hydrogensulfid ved vekselvirkning av metallisk jern (under hetten) med krystallinsk svovel, etterfulgt av samspillet mellom sulfid og svovelsyre.
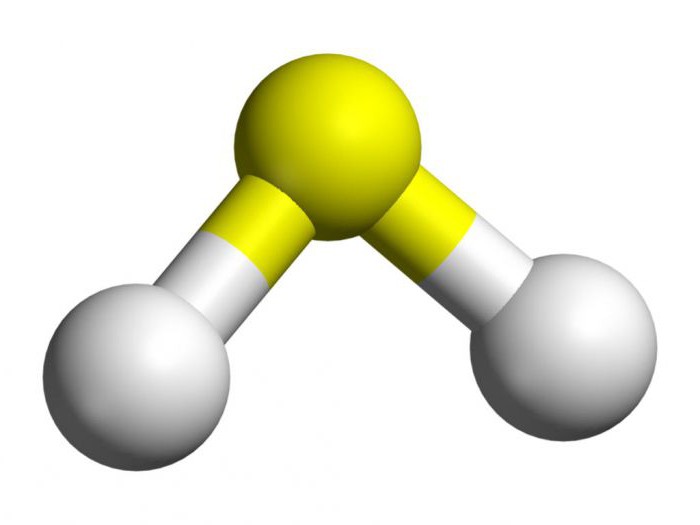
Kjemiske egenskaper
Hydrogen sulfid interagerer med oksygen i luften,Han tente en blålig farge. I tilfelle av fullstendig forbrenning Reaksjonsproduktene er svoveldioksyd (4), og vann. Gitt at ovnsgassen er et surt oksyd, i oppløsning, danner det en svak syre svovel- fargestoffer blått lakmuspapir rødt.
I tilfelle av en utilstrekkelig mengde hydrogensulfid dannes krystallinsk svovel. Denne prosessen anses å være en industriell metode for å oppnå rent svovel fra hydrogensulfid.
Denne kjemikalien er blitt identifisert oggode restaurerende evner. De manifesteres, for eksempel når de samhandler med salter, halogener. For å utføre en lignende reaksjon under laboratorieforhold, helles en oppløsning av hydrogensulfid i reagensrørene med klor og brom, og misfarging observeres. Som reaksjonsproduktet observeres dannelsen av krystallinsk svovel.
Den kjemiske reaksjonen av hydrogensulfid med vann fører til dannelsen av hydroksoniumkation H3O +.
Hydrogensulfid er i stand til å danne to slags forbindelser: sulfider (middelsalt) og hydrosulfider (syre salter).
I alkaliske og jordalkalimetaller, sulfiderer fargeløse forbindelser. I tungmetaller (kobber, nikkel, bly) er de svarte. Mangansulfid har en rosa farge. Mange salter oppløses ikke i vann.
En kvalitativ reaksjon på sulfider er samspillet med en løsning av kobbersulfat (2). Produktet av denne interaksjonen er utfelling av et svart bunnfall av kobbersulfid (2).
konklusjon
I naturen finnes dette stoffet i mineralkilder, vulkanske gasser. Denne forbindelsen er et produkt av forfall av dyr og planteorganismer, det utmerker seg ved en karakteristisk lukt av hydrogensulfid. Naturlige sulfider finnes i sammensetningen av sjeldne metaller, i metallurgi fra dem blir de tilsvarende elementene oppnådd. Det er også viktig å huske at hydrogensulfid er en sterk gift.





