Internasjonal nomenklatur for alkaner. Alkaner: struktur, egenskaper
Det er nyttig å begynne med definisjonen av konseptetalkaner. Det er mettede eller mettede hydrokarboner, paraffiner. Det kan også sies at dette er karboner der kombinasjonen av C-atomer utføres gjennom enkle bindinger. Den generelle formel har formen: CnH2n + 2.
Det er kjent at forholdet mellom antall H og C-atomeri deres molekyler så mye som mulig, hvis sammenlignet med andre klasser. I lys av det faktum at alle valenser er okkupert med enten C eller H, er de kjemiske egenskapene til alkanene ikke tilstrekkelig uttalt, derfor er andre termen termen mettede eller mettede hydrokarboner.
det er også en mer gamle navnet som best reflekterer deres relative himinertnost - parafiner, som oversatt betyr "mangler tilhørighet".
Så temaet for dagens samtaler er: "Alkaner: homologierier, nomenklatur, struktur, isomerisme". Data om deres fysiske egenskaper vil også bli presentert.
Alkaner: bygning, nomenklatur
I dem er C-atomer i en slik tilstand somsp3 hybridisering. I dette henseende kan alkanmolekylet bli vist som et sett med tetraedrale C-strukturer som ikke bare er relatert til hverandre, men også til H.

Mellom C og H atomer er sterke, veldiglavpolaritet s-obligasjoner. Atomer rundt enkle bindinger roterer alltid, slik at alkanolmolekylene antar en rekke former, med lengden på bindingen, vinkelen mellom dem er konstant. Skjemaer som forvandles til hverandre på grunn av rotasjonen av molekylet som forekommer rundt σ-bindingene, er det vanlig å kalle det konformasjoner.

I prosessen med frigjøring av atom H fra den vurdertemolekyler dannes 1-valent partikler, kalt hydrokarbonradikaler. De fremstår som følge av forbindelser av ikke bare organiske stoffer, men også uorganiske forbindelser. Hvis vi tar 2 hydrogenatomer fra molekylet til det ultimate hydrokarbon, får vi 2-valente radikaler.
Nomenklaturen til alkaner kan således være:
- radial (gammel versjon);
- erstatning (internasjonal, systematisk). Det foreslås av IUPAC.
Funksjoner av radialnomenklaturen
I det første tilfellet kjennetegnes nomenklaturen for alkaner av følgende:
- Behandling av hydrokarboner som derivater av metan, hvor ett eller flere H-atomer er substituert med radikaler.
- Høy grad av bekvemmelighet i tilfelle ikke veldig komplekse forbindelser.
Egenskaper i erstatningsnomenklaturen
Den alkaliske nomenklaturen har følgende funksjoner:
- Grunnlaget for navnet er 1 karbonkjede, mens de resterende molekylfragmentene anses som substituenter.
- I nærvær av flere identiske radikaler, før deres navn indikeres tallet (strengt i ord), og de radikale tallene skilles fra kommaer.
Kjemi: Nomenklatur av alkaner
For enkelhets skyld presenteres informasjonen i form av et bord.
Navn på stoffet | Grunnlaget for navnet (root) | Molekylær formel | Navnet på karbon-substituenten | Karbon-substituentformelen |
metan | meth | CH₄ | methyl | CH |
etan | etno | C₂H₆ | etyl | C₂H₅ |
propan | prop | C₃H₈ | Har drukket | C₃H₇ |
butan | men- | C₄H₁₀ | butyl | C₄H₉ |
pentan | Pent | C₅H₁₂ | pentyl | C₅H₁₁ |
heksan | hex | C₆H₁₄ | heksyl | C₆H₁₃ |
heptan | Olhept | C₇H₁₆ | heptyl | C₇H₁₅ |
oktan | oktober | C₈H₁₈ | oktyl | C₈H₁₇ |
nonane | n videre | C₉H₂₀ | nonyl | C₉H₁₉ |
dekan | dekstran | C₁₀H₂₂ | decyl | C₁₀H₂₁ |
Ovennevnte nomenklatur for alkaner inneholder navn som har utviklet seg historisk (de fire første medlemmene av en rekke terminale hydrokarboner).
Navn på ikke-distribuerte alkaner med 5 eller flereC-atomer er dannet av greske tall som reflekterer et gitt antall C-atomer. Så sier suffikset-at stoffet er fra en rekke mettede forbindelser.

Ved å samle navnene på de distribuerte alkanene iHovedkjedeens rolle er den som inneholder det maksimale antall C-atomer. Det er nummerert slik at substituentene har det laveste antall. I tilfelle av to eller flere kjeder av samme lengde blir hoveddelen den som inneholder det største antall substituenter.
Alkanisomerisme
Som en banebrytende hydrokarbon-seriemetan står CH 锟 斤 拷. Med hver etterfølgende representant for metanserien er det en forskjell fra den forrige av metylengruppen - CH2. Dette mønsteret kan spores gjennom hele serien av alkaner.
Tysk forsker shil fremsatt et forslag om å kalle denne serien homologe. Oversatt fra gresk betyr "lignende, lignende."
Dermed er den homologe serien settetrelaterte organiske forbindelser med samme type struktur med tette kjemiske egenskaper. Homologer er medlemmer av denne serien. Den homologe forskjellen er metylengruppen, hvorved de 2 nabostillede homologene er forskjellige.
Som nevnt tidligere, sammensetningen av noenmettet hydrokarbon kan uttrykkes med den generelle formel CnH2n + 2. Medlemmet i den homologe serien som følger metan er således etan-C2H6. For å utlede strukturen fra metan, er det nødvendig å erstatte 1 H atom med CH3 (figur nedenfor).

Strukturen av hver påfølgende homolog kan avledes fra den forrige på samme måte. Som et resultat dannes propan fra etan-C3H8.
Hva er isomerer?
Dette er stoffer som har identiskekvalitativ og kvantitativ molekylær sammensetning (identisk molekylær formel), men forskjellig kjemisk struktur, samt har forskjellige kjemiske egenskaper.
Ovennevnte hydrokarboner er forskjellige ien parameter som kokepunkt: -0,5 ° - butan, -10 ° - isobutan. Denne typen isomeri er referert til som karbonskjelett-isomerisme, det refererer til den strukturelle typen.
Antallet strukturelle isomerer vokser rasktpriser med økende mengder karbonatomer. Således vil C10H22 korrespondere med 75 isomerer (ikke inkludert romlig), og 4347 isomerer er allerede kjent for C15H23, for C20H4-2366.319.
Så det har allerede blitt klart hva alkaner er, homologe serier, isomeri, nomenklatur. Nå er det nødvendig å gå til regler for sammensetning av navn ved IUPAC.
IUPAC-nomenklatur: regler for dannelse av navn
Først må du finne i hydrokarbonstrukturen av karbonkjeden, som er den lengste og inneholder det maksimale antall substituenter. Deretter kreves det å nummerere atomene i C-kjeden, startende fra slutten som substituenten er nærmest.
For det andre er grunnlaget navnet på et uforgrenet mettet hydrokarbon, som hovedkjeden tilsvarer antall C-atomer.
For det tredje, før basen, må du angi nummerene til lokalene, i nærheten av hvilke varamedlemmer er lokalisert. De er skrevet med en bindestrek etter navnene til varamedlemmer.
Fjerde, i tilfelle identisksubstituenter på forskjellige C-atomer, kombineres kobberne, med et multipliseringsprefik som står foran navnet: di for to identiske substituenter, tre for tre, tetra for fire, penta for fem, etc. og fra ordene - en bindestrek.
Hvis det samme C-atomet inneholder to substituenter samtidig, blir lokalisten også registrert to ganger.
I følge disse reglene er den internasjonale nomenklaturen for alkaner dannet.

Newmans prognoser
Denne amerikanske forskeren foreslo spesielle projeksjonsformler, Newmans projeksjoner, for grafisk demonstrasjon av konformasjoner. De tilsvarer skjemaene A og B og presenteres i figuren nedenfor.
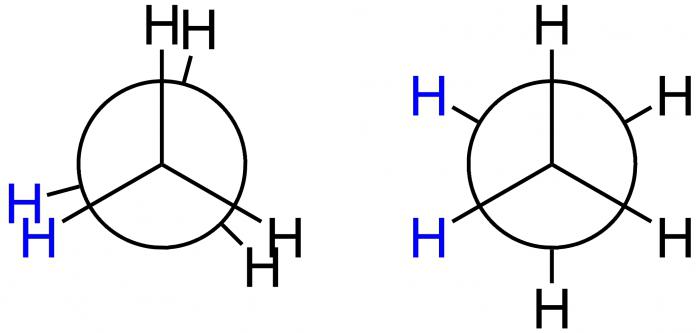
I det første tilfellet er dette den A-skjermede konformasjonen, ogi den andre - B-hemmede. I posisjon A er H-atomer plassert i en minste avstand fra hverandre. Dette skjemaet tilsvarer høyeste energiværdi, på grunn av at avstøtningen mellom dem er størst. Dette er en energisk ugunstig tilstand, som følge av at molekylet har en tendens til å forlate den og beveger seg til en mer stabil stilling B. Her er H-atomer så langt fra hverandre som mulig. Dermed er energidifferansen for disse stillingene 12 kJ / mol, på grunn av hvilken fri rotasjon rundt aksen i etanmolekylet, som forbinder metylgruppene, er ujevn. Etter å ha fallet inn i en energisk gunstig posisjon, blir molekylet forsinket der, med andre ord, er det "hemmet". Det er derfor det kalles hemmet. Resultatet - 10 000 molekyler etan forblir i den hemmet form av konformasjonen under romtemperatur. Bare en har en annen form - skjult.
Oppnå mettede hydrokarboner
Fra artikkelen er det allerede blitt kjent at disse er alkaner.(struktur, nomenklatur av dem beskrevet i detalj tidligere). Det ville være nyttig å vurdere måter å skaffe dem på. De skiller seg ut fra naturlige kilder som olje, naturgass, kull og kull. Syntetiske metoder benyttes også. For eksempel, H2 2H2:
- Hydrogeneringsprosessen av umettede hydrokarboner: CnH2n (alkener) → CnH2n + 2 (alkaner) ← CnH₂n-2 (alkyner).
- Fra en blanding av monoksid C og H - syntese gass: nCO + (2n + 1) H2 → CnH2n + 2 + nH20.
- Fra karboksylsyrer (deres salter): elektrolyse ved anoden ved katoden:
- Kolbe-elektrolyse: 2RCOONa + 2H20 → R-R + 2C02 + H2 + 2NaOH;
- Dumas-reaksjon (legering med alkali): CH3COONa + NaOH (t) → CH4 + Na2CO3.
- Oljesprekking: CnH2n + 2 (450-700 °) → CmH2m + 2 + Cn-mH2 (n-m).
- Gassifisering av drivstoff (faststoff): C + 2H2 → CH4.
- Syntese av komplekse alkaner (halogenderivater) som har et mindre antall C-atomer: 2CH3Cl (klormetan) + 2Na → CH3-CH3 (etan) + 2NaCl.
- Vann dekomponering av metanider (metallkarbider): Al4C3 + 12H20 → 4Al (OH3) ↓ + 3CH4 ↑.
Fysiske egenskaper av mettede hydrokarboner
For enkelhets skyld grupperes dataene inn i et bord.
formel | alkaner | Smeltepunkt i ° C | Kokepunkt i ° C | Tetthet, g / ml |
CH₄ | metan | -183 | -162 | 0,415 ved t = -165 ° C |
C₂H₆ | etan | -183 | -88 | 0,561 ved t = -100 ° C |
C₃H₈ | propan | -188 | -42 | 0,583 ved t = -45 ° C |
n-C₄H₁₀ | n-butan | -139 | -0,5 | 0,579 ved t = 0 ° C |
2-metylpropan | - 160 | - 12 | 0,557 ved t = -25 ° C | |
2,2-dimetyl-propan | - 16 | 9,5 | 0,613 | |
n-C₅H₁₂ | n-pentan | -130 | 36 | 0,626 |
2-metylbutan | - 160 | 28 | 0,620 | |
n-C₆H₁₄ | n-Heksan | - 95 | 69 | 0,660 |
2-metylpentan | - 153 | 62 | 0,683 | |
n-C₇H₁₆ | n-Heptan | - 91 | 98 | 0,683 |
n-C₈H₁₈ | n-oktan | - 57 | 126 | 0,702 |
2,2,3,3-tetra-metylbutan | - 100 | 106 | 0,656 | |
2,2,4-trimetyl-pentan | - 107 | 99 | 0,692 | |
n-C₉H₂₀ | n-nonan | - 53 | 151 | 0,718 |
n-C₁₀H₂₂ | n-dekan | - 30 | 174 | 0,730 |
n-C₁₁H₂₄ | n-undecan | - 26 | 196 | 0,740 |
n-C₁₂H₂₆ | n-dodekan | - 10 | 216 | 0,748 |
n-C₁₃H₂₈ | n-tridekan | - 5 | 235 | 0,756 |
n-C₁₄H₃₀ | n-tetradekan | 6 | 254 | 0,762 |
n-C₁₅H₃₂ | n-pentadekan | 10 | 271 | 0,768 |
n-C₁₆H₃₄ | n-heksadekan | 18 | 287 | 0,776 |
n-C₂₀H₄₂ | n-eicosan | 37 | 343 | 0,788 |
n-C₃₀H₆₂ | n-Triakontan | 66 | 235 kl 1 mmHg Artikkel | 0,779 |
n-C₄₀H₈₂ | n-Tetrakontan | 81 | 260 på 3 mmHg Art. | |
n-C₅₀H₁₀₂ | n-Pentakontan | 92 | 420 når 15 mmHg Art. | |
n-C₆₀H₁₂₂ | n-Geksakontan | 99 | ||
n-C₇₀H₁₄₂ | n-Geptakontan | 105 | ||
n-C₁₀₀H₂₀₂ | n-Gektan | 115 |
konklusjon
Artikkelen ble ansett som en ting somalkaner (struktur, nomenklatur, isomerisme, homologe serier, etc.). Det er litt fortalt om funksjoner i radial- og erstatningsnomenklaturen. Beskriver hvordan man oppnår alkaner.
I tillegg lister artikkelen i detalj hele spekteret av alkaner (testen kan bidra til å assimilere informasjonen som er oppnådd).




